Dysponent: Politechnika Warszawska
Kontakt: dr Katarzyna Lech ![]()
Opis techniki
Wysokosprawna chromatografia cieczowa połączona z detektorem spektrofotometrycznym i detektorem spektrometrii mas z jonizacją poprzez elektrorozpraszanie (HPLC-UV-Vis-ESI MS) jest techniką inwazyjną pozwalającą na rozdzielenie i identyfikację naturalnych związków barwiących wchodzących w skład barwników organicznych używanych m.in. do barwienia tkanin.
Zastosowanie odpowiednio dobranego układu chromatograficznego pozwala na rozdzielenie związków barwnych w zależności od ich właściwości fizyko-chemicznych, a czasy retencji (czasy przebywania analitów wewnątrz kolumny chromatograficznej) po porównaniu ich wartości z czasami retencji wzorców pozwalają na ich identyfikację. Związki opuszczające kolumnę chromatograficzną są rejestrowane na chromatogramach w postaci pików za pomocą dwóch połączonych szeregowo detektorów, spektrofotometrycznego i detektora spektrometrii mas z jonizacją poprzez elektrorozpraszanie. Zastosowanie detektora spektrofotometycznego UV-Vis umożliwia rejestrację pików związków barwnych, natomiast spektrometr mas pozwala je zidentyfikować w oparciu o stosunek ich masy do ładunku (m/z). Cząsteczki obojętne związków wprowadzanych do spektrometru mas ulegają w nim jonizacji, a następnie są rozdzielane zgodnie z ich wartością m/z, co jest podstawą ich identyfikacji. Zastosowanie tandemowego spektrometru mas (MS/MS) pozwala dodatkowo poddać związek fragmentacji i zarejestrować tzw. widmo jonów potomnych, stanowiące jego swoisty „odcisk palca”. Układ taki umożliwia bezwzorcową identyfikację nawet nieznanych substancji. W przypadku barwników organicznych za pomocą HPLC-UV-Vis-ESI MS/MS stosowany jest przede wszystkim tryb monitorowania wybranych reakcji fragmentacji (MRM), który pozwala śledzić tylko wybrane jony-fragmenty, dzięki czemu metoda jest czuła i selektywna.
Zastosowanie
W badaniach obiektów zabytkowych technika znajduje zastosowanie przede wszystkim do identyfikacji w tkaninach:
- związków barwiących występujących w barwnikach naturalnych (analiza porównawcza w oparciu o bazę wzorców)
- związków barwiących wchodzących w skład wczesnych barwników syntetycznych (analiza porównawcza w oparciu o bazę wzorców, a także bezwzorcowa identyfikacja na podstawie widm MS/MS)
Postępowanie analityczne wymaga pobrania próbki włókna o długości 1-10 mm (w zależności od intensywności wybarwienia i rodzaju użytego barwnika). Badaniom można poddawać nawet wyblakłe lub zniszczone włókna, gdyż metoda jest czuła i pozwala identyfikować związki występujące nawet w śladowych ilościach.
Możliwość identyfikacji barwników naturalnych jest ograniczona do związków znajdujących się w bazie danych. W niektórych przypadkach, z uwagi na duże podobieństwa barwników, zidentyfikowane związki chemiczne pozwalają jedynie na określenie grupy barwników, która mogła zostać użyta do barwienia analizowanej nici. Gdy barwnik mógł być otrzymany z różnych gatunków roślin – ustalenie gatunku również najczęściej nie jest możliwe.
Aparatura
Badania są prowadzone za pomocą wysokosprawnego chromatografu cieczowego połączonego z detektorem spektrofotometrycznym i detektorem spektrometrii mas z jonizacją poprzez elektrorozpraszanie (HPLC-UV-Vis-ESI MS, HPLC-UV-Vis-ESI MS/MS).
Parametry HPLC:
- typ: pompa czteroskładnikowa
- zakres przepływu: 0,2 – 10,0 mL/min
- maksymalne ciśnienie: 400 bar
Parametry UV-Vis:
- zakres pracy lampy: 190 – 600 nm
- dokładność długości fali: ± 1 nm
- długość drogi optycznej: 10 mm
- objętość celi pomiarowej: 14 μL
- maksymalne ciśnienie: 40 bar
Parametry ESI MS:
- tryb jonizacji: dodatni, ujemny
- zakres mas: 50 – 1500 m/z
- dokładność masy: ± 0,13 u w skalibrowanym zakresie mas w trybie skanowania
- tryby rejestracji: tryb skanujący/pełnego przemiatania jonów, tryb monitorowania wybranego jonu
Parametry ESI MS/MS:
- tryb jonizacji: dodatni, ujemny
- zakres mas: 5 – 3000 m/z
- dokładność masy: 0,1 Da dla 5 – 1000 m/z; 0,01% dla 1000 – 2000 m/z; 0,02% dla 2000 – 3000 m/z
- tryby rejestracji: tryb skanujący/pełnego przemiatania jonów, tryb przemiatania jonów potomnych, tryb przemiatania jonów macierzystych, tryb śledzenia jonów tracących fragment obojętny o stałej masie, tryb śledzenia wybranych reakcji fragmentacji (MRM), tryb monitorowania wybranego jonu
- maksymalna szybkość skanowania: 12500 Da/s
- minimalny czas przebywania MRM: 1 ms
- liczba reakcji fragmentacji MRM: 450 w jednym segmencie czasowym; > 40000 reakcji fragmentacji w jednej metodzie
- liczba dynamicznych reakcji fragmentacji MRM: 4000 fragmentacji w jednej metodzie
Warunki badania
Do analizy niezbędna jest nić o długości 1-10 mm. W przypadku, gdy należy przeprowadzić bezwzorcową identyfikację nieujętych w metodzie związków barwnych, niezbędna może okazać się nić dłuższa (np. 20 mm). Związki barwiące są ekstrahowane za pomocą mieszaniny polarnych rozpuszczalników i następnie rozdzielane chromatograficznie w odwróconym układzie faz. Metodyka wymaga przeprowadzenia czterech analiz każdej nici. Jedno postępowanie trwa około godziny.
Format wyników pomiarów
Dysponent obiektu otrzymuje wyniki pomiarów w postaci raportu zawierającego chromatogramy oraz ich podstawową interpretację. W przypadku przygotowywania wyników do publikacji mogą być opracowane dodatkowe ilustracje, przygotowane zgodnie z wymogami edytora.
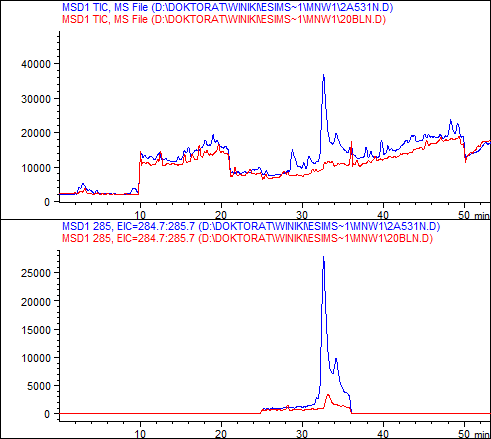
Rys. 1. Przykładowy wynik badania HPLC-ESI MS
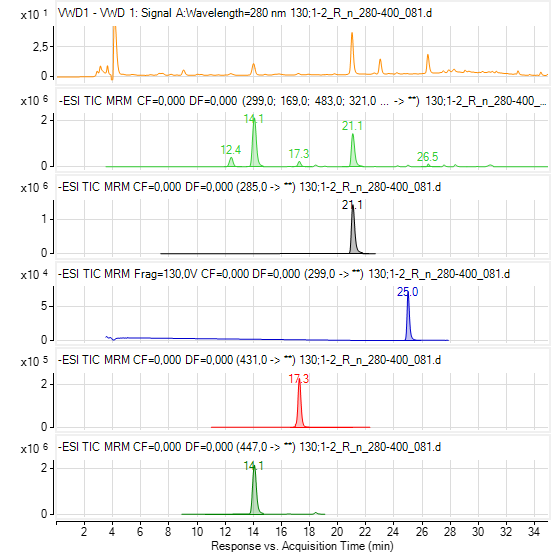
Rys. 2. Przykładowy wynik badania HPLC-UV-Vis-ESI MS/MS
Przykładowe wyniki badań przeprowadzonych z użyciem zestawu aparaturowego HPLC-UV-Vis-ESI MS można znaleźć w publikacjach:
- Lech, M. Jarosz „Novel methodology for the extraction and identification of natural dyestuffs in historical textiles by HPLC–UV-Vis–ESI MS. Case study: chasubles from the Wawel Cathedral collection” Analytical and Bioanalytical Chemistry 399, 3241–3251 (2011), DOI: 10.1007/s00216-010-4591-x
- Puchalska, E. Orlińska-Mianowska, E. Rosłoniec, I. Pannenko, J. Witowska-Jarosz, K. Połeć-Pawlak, M. Jarosz „Badania zabytkowych tkanin na przykładzie XVI-wiecznej brokateli”, w G. Śliwiński (Ed.) Techniki analityczne w konserwacji zabytków, Wydawnictwo Instytutu Maszyn Przepływowych, Gdańsk, 2006, str. 84-88
- Połeć-Pawlak, M. Puchalska, A. Miszczak, E. Rosłoniec, M. Jarosz „Blue natural organic dyestuffs – from textile dyeing to mural painting. Separation and identification of coloring matters present in elderberry, logwood and indigo” Journal of Mass Spectrometry 41, 613-622 (2006), DOI: 10.1002/jms.1018
- Puchalska, K. Połeć-Pawlak, I. Zadrożna, H. Hryszko, M. Jarosz „Identification of indigoid dyes in natural organic pigments used in historical art objects by high performance liquid chromatography coupled to electrospray MS” Journal of Mass Spectrometry 39, 1441-1449 (2004), DOI: 10.1002/jms.728
- Lech, K. Witkoś, B. Wileńska, M. Jarosz „Identification of unknown colorants in pre-Columbian textiles dyed with American cochineal (Dactylopius coccus Costa) using high-performance liquid chromatography and tandem mass spectrometry” (2015) Analytical and Bioanalytical Chemistry 407, 855-867 (2015), DOI: 10.1007/s00216-014-8107-y
- Lech, M. Jarosz „HPLC–UV-Vis–ESI MS Examination of Archeological Fibers – Red Natural Dyes in Italian Textiles from 15th and 16th Centuries” w: Zuo Y (Ed.) High-performance liquid chromatography (HPLC): principles, practices and procedures. Nova Science Publishers, New York, 2014, str. 299-316
- Lech, E. Wilicka, J. Witowska-Jarosz, M. Jarosz „Early synthetic dyes – a challenge for tandem mass spectrometry” Journal of Mass Spectrometry 48, 141-147 (2013), DOI: 10.1002/jms.3090

